Fenol
| Fenol | |
|---|---|
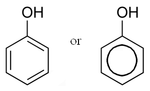  |
|
| Obecné | |
| Systematický název | fenol |
| Triviální název | kyselina karbolová, karbol |
| Ostatní názvy | benzenol,hydroxybenzen |
| Funkční vzorec | C6H5OH |
| Sumární vzorec | C6H6O |
| Identifikace | |
| Registrační číslo CAS | 108-95-2 |
| EC-no (EINECS/ELINCS/NLP) | 203-632-7 |
| Indexové číslo | 604-001-00-2 |
| Vlastnosti | |
| Molární hmotnost | 94,11 g/mol |
| Teplota tání | 40,5 °C |
| Teplota varu | 181,7 °C |
| Hustota | 1,07 g/cm³ |
| Disociační konstanta pKa | 9,95 |
| Rozpustnost ve vodě | 8,3 g/100 ml (20 °C) |
| Bezpečnost | |
 Toxický (T)  Žíravý (C) |
|
| R-věty | R23/24/25 R34R48/20/21/22 R68 |
| S-věty | (S1/2) S24/25 S26 S28S36/37/39 S45 |
|
|
|
| H-věty | H341 H331 H311 H301H373 H314 |
| Teplota vznícení | 715 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). |
|

Fenol
Fenol (též známý jako kyselina karbolová, hydroxybenzen, karbol, benzenol) je jedovatá bezbarvá krystalická pevná látka sladkéhodehtového zápachu, často označovaného jako „vůně nemocnice“. Chemický vzorec fenolu je C6H5OH a jeho molekula obsahujehydroxylovou funkční skupinu (-OH) vázanou na benzenové jádro, jde tedy o aromatickou sloučeninu.
Fenoly
- Hlavní článek: Fenoly
Slovo fenol se používá také pro jakoukoli sloučeninu, která obsahuje šestičlenný aromatický kruh s přímo navázanou hydroxylovou skupinou (-OH). Proto se jako fenoly označuje třída organických sloučenin, jejímž nejjednodušším členem je fenol, jímž se zabývá tento článek. Barva je bílá, žíravá látka.
Vlastnosti
Fenol se omezeně rozpouští ve vodě (8,3 g/100 cm3); zároveň je voda omezeně rozpustná ve fenolu (přibližně 28 g/100 cm3), tedy v poměrech mezi 8,3 g/100 cm3 a 72 g/100 cm3 jsou za běžné teploty voda s fenolem nemísitelné, oddělují se fáze roztoku vody ve fenolu (těžší) a roztoku fenolu ve vodě (lehčí). Při teplotách nad 68,8 °C je fenol s vodou mísitelný v každém poměru. Při teplotách mezi běžnou a 68,8 °C se stoupající teplotou rozpustnost fenolu ve vodě i rozpustnost vody ve fenolu stoupá, oba roztoky však zůstávají navzájem nemísitelné.[1][2] Je mírně kyselý (je to slabší kyselina než voda): molekula fenolu má mírnou tendenci odštěpovat iont H+ z hydroxylové skupiny, čímž vzniká ve vodě velmi rozpustný fenoxidový (též fenolátový) anion C6H5O−. V porovnání s alifatickými alkoholy je fenol mnohem kyselejší; dokonce ve vodném roztoku reaguje s NaOH za ztráty H+, kdežto alifatické alkoholy nikoli. Jedním z vysvětlení zvýšené kyselosti je rezonanční stabilizace fenoxidového anionu aromatickým kruhem. Takto je záporný náboj kyslíku sdílen uhlíkovými atomy orto a para.[3] Podle jiného vysvětlení je zvýšená kyselost výsledkem přesahu orbitalů mezi volnými páry kyslíku a aromatickým systémem.[4]Třetím, dominantním účinkem je indukce hybridizovaných uhlíků; výrazně silnější indukční úbytek elektronové hustoty, který poskytuje systém sp² oproti systému sp³, umožňuje dobrou stabilizaci oxyanionu. Pro takový závěr lze vzít pKa enolu acetonu, která je 10,9, v porovnání s fenolem majícím pKa rovnu 10,0.[5]
Fenol je významnou složkou aromatu skotské whisky z Islay.
Výskyt v přírodě
Fenoly jsou v přírodě běžné, zejména v říši rostlin. V některých případech jsou přítomny v listech rostlin jako ochrana před okusovánímbýložravci, jako je tomu u západního jedovatého dubu (Toxicodendron diversilobum).
Poločas rozpadu fenolu v povrchových vodách je 55 hodin, v podzemních vodách 12-168 hodin, v sedimentech a plaveninách 550 hodin.[7]
Průmyslová výroba
Fenol se vyrábí částečnou oxidací benzenu nebo redukcí kyseliny benzoové kumenovou metodou nebo Raschigovým procesem. Lze jej také získat jako jeden z mnoha produktů při oxidaci uhlí. Největší množství[zdroj?] fenolu se vyrábí oxidací kumenu peroxidem vodíku za vzniku kumylhydroperoxidu. Ten přesmykuje v kyselém prostředí na fenol a aceton.
Použití
Fenol má antiseptické vlastnosti a byl použit Josephem Listerem (1827-1912) v jeho průkopnické metodě antiseptické chirurgie. Podráždění kůže způsobované nepřetržitou expozicí fenolu nakonec vedlo k náhradě této metody aseptickou chirurgií. Lister usoudil, že i samotné rány musí být důkladně čištěny. Proto je pokrýval kusem „hadru“ nebo „cupaniny“[8] namočeným v kyselině karbolové. Fenol je stále aktivní složkou některých orálních anestetik, například přípravku Chloraseptic. Byl též hlavní součástí karbolové dýmové koule, prodávané v Londýně v 19. století pro ochranu proti chřipce a dalším nemocím. Na začátku 20. století byl v Battle Creek Sanitariumnanášen na klitoris pro zamezení ženské masturbaci.[9]
Fenol se používá také pro výrobu léčiv (je počátečním surovinou pro průmyslovou výrobu kyseliny acetylsalicylové), herbicidů asyntetických pryskyřic (bakelit, první vyrobená syntetická pryskyřice, je polymer fenolu s formaldehydem). Expozice kůže koncentrovaným roztokům fenolu může způsobit vážné poleptání. Při používání fenolu v laboratoři se obvykle doporučuje mít k dispozici roztokpolyethylenglykolu jako oplach při polití fenolem. Nezbytné je opláchnutí velkým množstvím vody a odstranění kontaminovaného šatstva a v závažnějších případech okamžitá lékařská pomoc. Toto je zvlášť důležité, pokud je fenol smíchán s chloroformem (směs často používaná v molekulární biologii k čištění DNA a RNA od bílkovin).
Dalším použitím fenolu je výroba kosmetiky včetně opalovacích přípravků[10], barev na vlasy a přípravků pro bělení kůže.[11] Sloučeniny obsahující fenolické báze lze použít k ochraně vlasů a kůže proti ultrafialovému záření, protože aromatický kruh fenolu způsobuje velkou pohltivost tohoto záření. Tyto sloučeniny mohou vystupovat též jako antioxidanty (pro eliminaci volných radikálů) a mohou poskytovat ochranu proti předčasnému stárnutí a rakovině způsobené oxidačním stresem.
Fenol se využívá také v kosmetické chirurgii jako exfoliant, k odstranění vrstev mrtvé kůže. Jedním z použití je fenolizace, chirurgická procedura používaná při léčbě zarostlých nehtů, kdy se fenol aplikuje na prst, aby se zabránilo opětovnému zárůstu nehtu. Pětiprocentní roztok fenolu se někdy vstřikuje blízko senzorického nervu k dočasnému (do 1 roku) zastavení přenosu impulsů v některých úporných případech chronické neuropatické bolesti.
Druhá světová válka
Injekce fenolu se občas používaly pro rychlou popravu. Zejména byly používány nacisty za druhé světové války. Původně se tato metoda používala ve 30. letech jako součást programueuthanazie. Fenol, levný a rychle účinkující, byl v podobě injekcí volen hlavně v posledních dnech války. I když se k usmrcování větších skupin lidí používaly plynové komory (a v nich Cyklon B), shledali nacisté jako ekonomičtější u menších skupin usmrcovat každou osobu samostatně injekcí fenolu. Tyto injekce byly podány tisícům lidí v koncentračních táborech, zvláště v Osvětimi. Přibližně jeden gram fenolu je dostatečný k usmrcení. Injekce byly podávány lékaři, jejich asistenty, někdy též lékaři-vězni. Tyto injekce byly původně vstřikovány nitrožilně, nejčastěji do paže, ale později bylo preferováno vstříknutí přímo do srdce, které způsobilo téměř okamžitou smrt.[12] Jedním ze známých vězňů z Osvětimi, který byl usmrcen injekcí fenolu, byl Maxmilián Kolbe, katolický kněz, který dobrovolně tři týdny trpěl hladem a žízní místo jiného vězně, a byl nakonec zabit injekcí fenolu, aby nacisté uvolnili místo v cele[12].
Hydrotermální chemie
V laboratorních podmínkách napodobujících hydrotermální cirkulaci (voda 200 °C, 1,9 GPa) se fenol tvoří z hydrogenuhličitanu sodného a železného prášku (výtěžnost 1,8 %).[13] Tento objev z roku 2007 může být relevantní pro otázku původu života, protože fenol je fragmentem biomolekuly tyrosinu, ovšem je známo, že tyrosin v moderních biologických systémech vzniká přímo hydroxylací fenylalaninu.[14]
Účinky na zdraví
Fenol má leptavé účinky na všechny tkáně v těle. Rychle se vstřebává všemi cestami (včetně neporušené kůže), vzhledem k lipofilnímu charakteru rychle proniká do buněk a brzy se projevuje jeho systémová toxicita. Primární účinky jsou neurotoxické, cílovými orgány jsou játra a ledviny, výrazné dopady má i na dýchací a oběhový systém[15].
Kůže na ruce silně poleptaná fenolem
Při požití fenol vyvolává pálivou bolest. V ústech, jícnu a žaludku se objevuje bílá nekróza, fenol způsobuje zvracení a krvavý průjem. Kontakt s kůží vyvolává rovněž pálení, které je ale následně vystřídáno necitlivostí a zběláním kůže[15].
Mezi projevy systémové toxicity patří bolesti hlavy, závratě, hypotenze, komorová arytmie, mělký dech (s charakteristickým zápachem dechu), pobledlost až cyanóza. V počáteční fáze se může objevit excitace a křeče, brzy ale nastupuje útlum až bezvědomí. Může nastat pokles tělesné teploty a plicní edém, občas také methemoglobinémie a hemolytická anémie[15].
Dosavadní informace nenasvědčují významným kumulativním účinkům při chronické expozici[15].
Při expozici parám fenolu se vstřebává velmi rychle jak plícemi, tak kůží. Při osmihodinové inhalační expozici koncentracím 6 až 20 mg/m3 se vstřebá 70-80 % fenolu. Při šestihodinové kožní expozice parám o koncentraci 5 až 25 mg/m3 se vstřebalo také 70-80 %. Koncentrace 5-10 % denaturujíbílkoviny v pokožce a mohou částečně omezit vstřebávání, vzniklý komplex však není stabilní, proto se může jeho pozdější disociací prodloužit působení fenolu na organismus. Kožní dávka 25 mg/kg podaná potkanům, prasatům a ovcím se vstřebala z více než 95 %[15].
Biologický poločas konjugovaného fenolu v lidském těle je cca 1 hodina, ale bylo hlášeno i 4-5 hodin. Fenol se metabolizuje především v jaterních buňkách konjugací s kyselinou glukuronovou na fenylglukuronid a podléhá také sulfaci na fenylsulfát. Vylučuje se (hlavně v podobě uvedenýchmetabolitů, ale i nezměněný) především močí, v malé míře také plícemi a stolicí[15].
Za příčinu smrti při velmi vysokých dávkách fenolu se považuje tlumivý účinek na CNS. Smrt může nastat i z jiných důvodů. Smrtelná dávka se pohybuje od 1 do 12 g. V jednom případě vyvolalo požití 4,8 g smrt do 10 minut, přežití bylo naopak hlášeno po požití 26,7 g fenolu, resp. po až 350 mg/kg. Případy polití koncentrovanějšími roztoky fenolu (zejména v dichlormethanu) se zasažením větších ploch těla v některých případech končily smrtí, a to i během několika minut[15].
Při zasažení kůže nebo očí fenolem je důležité rychlé opláchnutí vodou (nejlépe vlažnou) po dobu nejméně 10 minut nebo ještě lépepolyethylenglykolem po dobu 30 minut[15].
Orální LD50 u potkanů se pohybuje od 300 do 600 mg/kg. Dermální LD50 u potkanů a králíků je 670 – 1 400 mg/kg. Osmihodinová inhalační LC50 u potkanů je více než 900 mg/m3[15].



